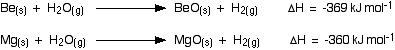Logam golongan 2 dari berilium Be, sampai radium, Ra, disebut juga logam-logam alkali tanah (Tabel 5.2). Berilium merupakan komponen beril atau emeral. Emeral adalah mineral yang mengandung 2%, Cr, dalam beril, Be3Al2Si6O18. Logam berilium bewarna putih keperakan dan digunakan dalam paduan khusus dan untuk jendela dalam tabung sinar-X, atau sebagai moderator dalam reaktor nuklir, dsb. Senyawa Be2+ mirip dengan senyawa Mg2+ atau Al3+. Karena berilium sangat beracun, berilium harus ditangani dengan sangat hati-hati.

Magnesium, Mg, terutama diproduksi sebagai karbonat, sulfat, dan silikat, dan kelimpahannya di antara natrium dan kalsium. Magnesium diproduksi dengan elektrolisis garam leleh magnesium khlorida, MgCl2, atau reaksi dolomit, CaMg(CO3)2, dengan paduan ferosilikon FeSi. Logam magnesium bewarna putih keperakan dan permukaannya dioksidasi di udara. Pada suhu tinggi magnesium terbakar di udara dan bereaksi dengan nitrogen menghasilkan nitrida, Mg3N2. Logam magnesium terbakar dengan nyala yang sangat terang dan sampai saat ini masih digunakan sebagai lampu blitz. Paduannya dengan aluminum bersifat ringan dan kuat dan digunakan sebagai bahan struktural dalam mobil dan pesawat. Mg2+ merupakan ion pusat dalam cincin porfirin dalam khlorofil, dan memainkan peran dalam fotosintesis. Reagen Grignard, RMgX, yang disintesis kimiawan Perancis F. A. V. Grignard tahun 1900, adalah senyawa organologam khas logam golongan utama dan digunakan dengan luas dalam Reaksi Grignard. Reagen yang penting ini dihadiahi Nobel (1912), dan sangat bermanfaat tidak hanya untuk reaksi organik tetapi juga untuk konversi halida logam menjadi senyawa organologam.
Kalsium ada dalam silikat, karbonat, sulfat, fosfat, fluorit, dsb. Kalsium bewarna putih keperakan, dan merupakan logam yang lunak diproduksi dengan elektrolisis garam kalsium khlorida, CaCl2 leleh.
Kapur tohor, CaO, diproduksi dengan kalsinasi batu pualam, CaCO3, pada 950-1100 oC. Jumlah produksi kapur tohor menempati ranking kedua produksi bahan kimia anorganik setelah asam sulfat. Kalsium hidroksida, Ca(OH)2, juga disebut kapur mati. Kalsium karbonat adalah komponen utama pualam dan pualam digunakan dalam produksi semen. Gipsum adalah dihidrat kalsium sulfat CaSO4.2H2O dan didapatkan dalam jumlah besar sebagai produk samping desulfurisasi gas, dan digunakan sebagai bahan bangunan, dsb.
Walaupun kalsium tidak penting baik dalam larutan dalam air maupun dalam kimia organologam dalam pelarut organik, unsur ini memerankan peran kunci dalam organisme hidup. Tidak hanya sebagai bahan struktural tulang dan gigi, ion kalsium juga memiliki berbagai fungsi biologis, seperti transfer aksi hormon, kontraksi otot, komunikasi syaraf, stabilisasi protein, dan pembekuan darah.
Stronsium adalah logam lunak dengan warna putih keperakan. Permukaannya dioksidasi oleh udara pada suhu kamar, dan menjadi oksidanya, SrO, dan nitridanya, Sr3N2, pada suhu tinggi. Walaupun kerak bumi relatif tinggi kandungan stronsiumnya, unsur ini belum dipelajari dengan luas dan aplikasinya agak terbatas. Ada empat isotop Sr, dan 88Sr (82.58 %) adalah yang paling 90Sr didapat dengan murah dalam reaksi inti, isotop ini digunakan sebagai sumber partikel β, dan sebagai perunut radioaktif. Namun, isotop ini, dan juga 137Cs, memiliki waktu paruh yang panjang (28.8 tahun) dan keduanya ada dalam sisa-sisa radioaktif yang menyertai uji ledakan nuklir.
Kimia barium, Ba, tidak luar biasa, tetapi BaSO4 digunakan sebagai media kontras untuk diagnostik sinar-X perut sebab senyawa ini tidak larut dalam asam khlorida. Ion Ba2+ sangat beracun dan larut dalam air yang mengandung ion ini harus ditangani dengan ekstra hati-hati.
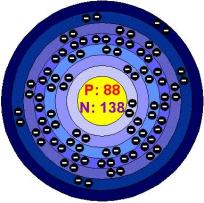
Walaupun radium, Ra, ada dalam bijih uranium, kandungannya hanya 10-6 kali kandungan uranium. Tuan dan Nyonya Curie telah mengisolasi sejumlah kecil uranium khlorida dari bertonton pitblenda di tahun 1898. Unsur uranium diisolasi oleh Curie melalui anamalgamnya. Walaupun radium memiliki nilai historis penting dalam radiokimia, kini radium tidak digunakan lagi sebagai sumber radiasi.
Sifat fisik dan sifat atom dari unsur-unsur golongan II
Pada halaman ini akan dijelaskan beberapa tren pada sifat fisik dan sifat atom dari unsur-unsur golongan II – berilium, magnesium, kalsium, strontium, dan barium.
Tren dalam Jari-jari Atom


Seperti terlihat di atas, semakin ke bawah jari-jari atom meningkat. Perhatikan bahwa berilium memiliki bentuk atom terkecil dibanding atom lain di golongan ini. Penjelasan peningkatan jari-jari atom
Jari-jari atom diatur oleh:
E Jumlah lapisan elektron di luar nukleus (inti atom).
E Gaya tarik dari nukleus terhadap elektron luar.
Bandingkan berilium dan magnesium:
Be 1s22s2
Mg 1s22s22p63s2
Untuk atom golongan II, dua elektron di kulit terluar mendapat gaya tarik total 2+ dari inti atom. Muatan positif dari nukleus dihilangkan atau dikurangi oleh muatan negatif dari elektron yagn terletak dikulit dalam.

Satu-satunya faktor yang mempengaruhi ukuran atom adalah jumlah kulit atom yang terisi elektron. Jelas sekali, semakin banyak kulit atom semakin banyak ruang yang dibutuhkan atom, mengingat elektron saling tolak-menolak. Ini berarti semakin kebawah (nomor atom makin besar) ukuran atom harus semakin besar.
Tren dalam Energi Ionisasi Pertama
Energi ionisasi pertama adalah energi yang diperlukan untuk memindahkan elektron yang paling lemah ikatannya, dari 1 mol atom menjadi ion bermuatan. Dengan kata lain, yang diperlukan untuk 1 mol proses ini:

Perhatikan bahwa semakin kebawah energi ionisasi pertama semakin menurun.
Penjelasan penurunan dalam energi ionisasi pertama
Energi ionisasi diatur oleh:
E muatan dalam inti atom,
E jumlah elektron dalam kulit-kulit atom dalam,
E jarak antara elektron terluar dengan inti atom.
Semakin ke bawah dalam golongan, peningkatan muatan inti atom diimbangi oleh peningkatan jumlah elektron dalam. Jadi, seperti telah dijelaskan sebelumnya, atom terluar tetap mendapat gaya tarik total 2+ dari inti atom.
Tetapi, semakin ke bawah jarak antara inti atom dengan elektron terluar meningkat, sehingga elektron semakin mudah dipindahkan, energi ionisasi yang diperlukan menurun.
Tren dalam Keelektronegatifan
Keelektronegatifan adalah ukuran kecenderungan atom untuk menarik pasangan elektron. Ukuran ini biasanya dibuat dalam skala Pauli, dimana unsur paling elektronegatif, yaitu fluorin, diberi angka 4,0.
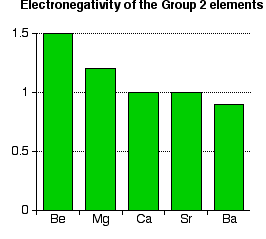
Semua unsur dalam golongan II ini memiliki sifat keelektronegatifan yang kecil (ingat, unsur paling elektronegatif, fluorin, memiliki keelektronegatifan 4,0). Perhatikan bahwa semakin kebawah keelektronegatifan semakin menurun. Atom-atom menjadi kurang mampu menarik pasangan elektron.
Anda mungkin tidak setuju dengan tren penurunan keelektronegatifan ini, karena pada tabel di atas terlihat kalsium dan strontium sama-sama memiliki keelektronegatifan 1,0. Ini dapat dijelaskan bahwa keelektronegatifan dicatat sampi 1 desimal saja. Misal kalsium memiliki keelektronegatifan 1,04 dan strontium 0,95 (angka permisalan!), keduan atom itu akan tercatat mempunyai keelekronegatifan 1,0.
Penjelasan penurunan dalam keelektronegatifan
Bayangkan ikatan antara atom magnesium dan atom klorin. Dimulai dengan ikatan kovalen dengan sepasang elektron koordinasi. Pasangan elektron akan tertarik ke arah klorin yang memiliki gaya tarik lebih besar dari inti atom klorin dibanding dari inti atom magnesium.
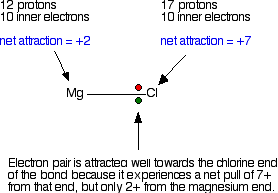
Pasangan elektron berada dekat dengan klorin sehingga terjadi transfer satu elektron kepada klorin, dan terbentuk ion.
Gaya tarik dari inti atom klorin yagn besar adalah sebab mengapa klorin memiliki keelektronegatifan yang lebih besar dari magnesium.
Selanjutnya bandingkan dengan ikatan antara berilium dan klorin. Gaya tarik total dari tiap atom sama dengan contoh pertama tadi. Tapi harus diingat, berilium memiliki ukuran atom yang lebih kecil dibanding magnesium. Ini berarti pasangan elektron akan berada lebih dekat dengan muatan total 2+ dari berilium, jadi lebih kuat terikat pada berilium.
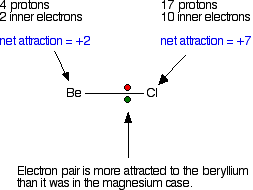
Pada contoh ini, pasangan elektron tidak tertarik cukup dekat pada klorin untuk membentuk ikatan ion. Karena ukurannya yang kecil, berilium membentuk ikatan kovalen, bukan ikatan ion. Gaya tarik antara inti berilium dengan pasangan elektron terlalu besar untuk dapat membentuk ikatan ion.
Kesimpulan tren ke bawah Golongan II
Semakin besar ukuran atom, setiap pasangan elektron semakin menjauh dari inti atom logam, jadi elektron kurang kuat untuk tertarik ke inti atom. Dengan kata lain, semakin kebaah dalam golongan, unsur semakin kurang elektronegatif.
Semakin ke bawah dalam golongan, ikatan yang terbentuk antara unsur-unsur ini dengan unsur lain, seperti klorin, menjadi semakin ionik. Pasangan elektron semakin mudah tertarik dari unsur golongan II ke unsur klorin (atau unsur lain).
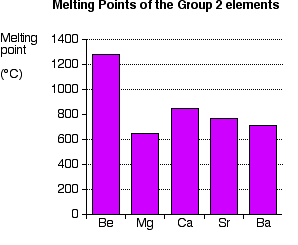
Tren dalam Titik Leleh
Terlihat pada tabel di atas bahwa (dengan perkecualian pada magnesium) semakin ke bawah titik didih semakin menurun.
Penjelasan tren dalam titik leleh
Penjelasan tentang kecenderungan tren pada titik leleh ini sangat sulit. Mungkin anda berpikir bahwa (kecuali magnesium) semakin rendah titik leleh semakin lemah ikatan logamnya, tetapi tidak, dan akan berbahaya untuk berpikir seperti itu. Ikatan logam tidak tidak dirusak oleh pelelehan. Tetapi dengan titik didih biasanya tolak ukur yang lebih baik dalam hal kekuatan ikatan yang terlibat.
Untuk titik leleh magnesium yang rendah, anda mungkin menemukan penjelasan adalah karena atom magnesium tersusun berbentuk kristal. Dan memang titik didih magnesium juga rendah. Tetapi pemikiran tentang susunan ini akan tidak relevan untuk unsur bentuk cairan. Untuk magnesium, pasti ada hal lain yang mempengaruhi lemahnya ikatan logam magnesium.
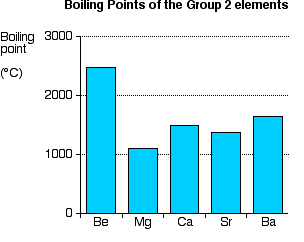
Untuk titik didih, tidak ada pola yang jelas dalam golongan II ini. Jadi, tidak ada pola yang jelas pula untuk kekuatan ikatan logam.
Ukuran lain yang munkin digunakan untuk kekuatan ikatan logam adalah energi ionisasi. Energi ionisasi adalah energi yang diperlukan untuk menghasilkan 1 mol atom dalam keadaan gas dari keadaan awalnya (yaitu keadaan dalam kondisi suhu dan tekanan ruang/ standar).

Lagi-lagi, tidak ada pola atau tren yang jelas dalam energi ionisasi ini. Dan memang belum ada penjelasan yang pasti mengenai ini.
Reaksi Unsur-unsur Golongan II dengan Udara atau Oksigen
Fakta
Reaksi dengan oksigen
Pembentukan oksida sederhana
Dengan oksigen, logam- logam Golongan III ini terbakar membentuk logam oksida sederhana.
Berilium sulit untuk terbakar kecuali dalam bentuk serbuk. Berilium memiliki lapisan berilium oksida yang tipis tetapi kuat pada permukaannya, yang mencegah oksigen baru untuk bereaksi dengan berilium dibawah lapisan tersebut.
2X + O2 → 2XO
X pada persamaan diatas menunjukkan logam Golongan II.
Agak mustahil untuk menemukan tren dalam reaksi logam Golongan II dengan oksigen. Karena untuk itu kita harus mendapat logam yang sama-sama bebas dari lapisan oksida, dengan luas permukaan dan bentuk yang setara, memiliki aliran oksigen yang setara, dan dipanaskan sampai sama-sama mulai bereaksi. Tetapi ini mustahil dilakukan!
Seperti apa logam-logam ini ketika dibakar sedikit rumit!
* Berilium: penulis belum dapat menemukan referensi (internet atau buku teks) mengenai warna api yang dihasilkan dari pembakaran berilium. Mungkin percikan perak seperti yang terjadi pada pembakaran magnesium atau alumunium.
* Magnesium: pembakarannya menghasilkan api berwarna putih kuat.
* Kalsium: agak sulit untuk mulai terbakar, tetapi kemudian terbakar cepat, menghasilkan api putih kemudian sedikit merah.
* Strotium: penulis belum pernah melihat pembakaran strontium, kemungkinan seperti kalsium, tetapi dengan warna merah yang lebih kuat.
* Barium: penulis hanya pernah melihat pembakaran barium melalui video, yang meyebutkan api yang dihasilkan adalah berwarna hijau pucat, tetapi yang terlihat api berwarna putih dengan sedikit hijau pucat.
Pembentukan peroksida
Strontium dan barium juga bereaksi dengan oksigen membentuk strontium atau barium peroksida.
Strontium membentuk strontium peroksida jika dipanaskan dengan oksigen di bawah tekanan tinggi, tetapi barium membentuk barium peroksida dengan pemanasan normal dengan oksigen. Pada reaksi ini akan dihasilkan campuran barium oksida dan barium peroksida.
Ba + O2 → BaO2
Persamman reaksi untuk strontium sama seperti persaman di atas.
Reaksi dengan udara
Reaksilogam-logam Golongan II dengan udara lebih rumit karena selain dengan oksigen, logam ini juga bereaksi dengan nitrogen menghasilkan nitrida. Pada tiap kasus, akan dihasilkan campuran logam oksida dan logam nitrida.
Persamaan umum untuk reaksi ini adalah:
3X + N2 → X3N2
Debu putih yang dihasilkan ketika membakar pita magnesium dengan udara adalah campuran magnesium okisida dan magnesium nitrida.
Penjelasan
Reaksi unsur-unsur golongan
II dengan air
Fakta-fakta
Berilium
Berilium tidak bereaksi dengan air atau uap air meskipun dalam suhu tinggi.
Magnesium
Magnesium bereaksi dengan uap air menghasilkan magnesium oksida dan hidrogen.
Mg + H2O → MgO + H2
Magnesium murni memiliki kemampuan bereaksi yang kecil terhadap air dingin. Reaksi di atas lekas terhenti karena terbentuknya magnesium hidroksida yang tidak larut dalam air dan membentuk rintangan bagi magnesium untuk bereaksi lebih lanjut.
Mg + 2H2O → Mg(OH)2 + H2
Sebagai catatan, jika logam bereaksi dengan uap air, terbentuk logam oksida. Jika bereaksi dengan air dingin, dihasilkan logam hidroksida.
Kalsium, strontium, dan barium
Unsur-unsur ini dapat bereaksi dengan air dingin dengan pengadukan kuat menghasilkan logam hidroksida dan hidrogen. Strontium dan barium memiliki reaktivitas mirip dengan litium di Golongan I. Persamaan reaksi unsur-unsur ini adalah :
X + 2H2O → X(OH)2 + H2
Logam hidroksida yang dihasilkan bersifat tidak larut air, tetapi kelarutannya meningkat ke bawah golongan. Kalsium hidroksida yang terbentuk sebagian besar berupa endapan putih (sebagian kecil larut). Untuk reaksi strontium akan dihasilkan endapan yang lebih sedikit, dan lebih sedikit lagi untuk reaksi barium, karena peningkatan kelarutan logam hidroksida tadi.
Rangkuman tren reaktivitas
Logam Golongan II semakin ke bawah reaktivitas dengan air semakin meningkat.
Penjelasan Mengenai Tren Reaktivitas
Perubahan Entalpi dalam reaksi
Perubahan entalpi dalam suatu reaksi menunjukkan jumlah panas yang diserap atau yang dikeluarkan selama raksi berlangsung. Perubahan entalpi negatif jika panas dikeluarkan, dan positif jika panas diserap.
Sebagai contoh, perhitungan perubahan entalpi dalam reaksi antara berilium atau magnesium dan uap air :
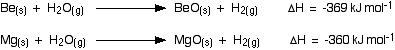
Kedua reaksi di atas adalah sangat eksotermis, mengeluarkan panas dengan jumlah sama. Tetapi, hanya reaksi magnesium yang benar-benar terjadi. Sebab perbedaan reaktivitas kedua unsur ini ada dalam penjelasan lain.
Perhitungan perubahan entalpi untuk kalsium, strontium, atau barium dengan air dingin, akan juga menghasilkan panas dengan jumlah yang sama dalam tiap reaksi, yaitu sekitar -430 kJ mol-1.
Energi aktivasi dalam reaksi
Energi aktivasi adalah jumlah minimum energi yang diperlukan untuk menghasilkan sebuah reaksi. Tidak peduli eksotermiknya suatu reaksi, jika ada halangan energi aktivasi, reaksi akan berlangsung sangat lambat.
Ketika logam Golongan II bereaksi membentuk oksida atau hidroksida, terlebih dahulu terbentuk ion logam.
Pembentukan ion ini melibatkan beberapa tahap reaksi yang memerlukan masukan energi, untuk energi aktivasi reaksi. Tahapan reaksi ini melibatkan :
* Energi atomisasi dari logam. Ini adalah energi yang diperlukan untuk memecah ikatan atom dalam logam.
* Energi ionisasi + yang pertama. Energi ini penting untuk mengubah atom logam menjadi ion dengan muatan 2+.
Setelah tahapan tersebut, ada beberapa langkah dalam reaksi yang mengeluarkan energi, menghasilkan keseluruhan reaksi eksotermik dan produk reaksi.
Grafik di bawah ini memperlihatkan efek dari tahap penyerapan energi pada reaksi unsur Golongan II.
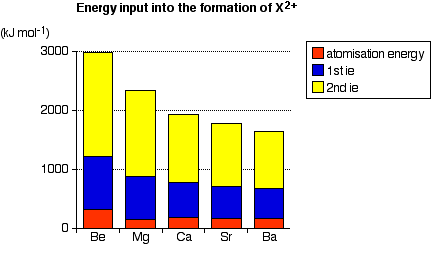
Perhatikan bahwa energi ionisasi mendominasi tahapan ini, terutama energi ionisasi kedua. Energi ionisasi semakin menurun ke bawah Golongan, karena semakin ke bawah logam semakin mudah membentuk ion, sehingga reaksi lebih mudah terjadi.
Rangkuman dalam peningkatan reaktivitas ke bawah Golongan
Reaksi lebih mudah terjadi jika energi yang dibutuhkan untuk membentuk ion positif kecil. Ini terutama karena penurunan energi ionisasi ke bawah Golongan, menyebabkan rendahnya energi aktivasi, dan reaksi yang lebih cepat.
referensi : http://jabirbinhayyan.wordpress.com/2009/11/28/logam-golongan-utama/
 Alkali tanah elemen elemen logam ditemukan dalam kelompok kedua tabel periodik. Semua unsur alkali tanah memiliki jumlah oksidasi +2, membuat mereka sangat reaktif. Karena reaktivitas, logam yang bersifat basa tidak ditemukan bebas di alam.
Alkali tanah elemen elemen logam ditemukan dalam kelompok kedua tabel periodik. Semua unsur alkali tanah memiliki jumlah oksidasi +2, membuat mereka sangat reaktif. Karena reaktivitas, logam yang bersifat basa tidak ditemukan bebas di alam.











 Rabu, September 09, 2009
Rabu, September 09, 2009
 Unknown
Unknown